Bu yılki Kimya Nobel Ödülü, biyolojinin en büyük problemlerinden biri olan proteinlerin 3D yapısının tahmin edilmesi ve sıfırdan tasarlanması konusunda yapay zekâ araçlarının geliştirilmesine katkıda bulunan üç bilim insanına verildi. AlphaFold adlı yapay zekâ sistemini geliştiren DeepMind’den John Jumper ve Demis Hassabis, protein yapılarını tahmin ve tasarlamada yapay zekâyı kullanarak biyolojiye önemli bir katkıda bulundular. Aynı ödül, Washington Üniversitesi’nde protein tasarımı üzerine çalışmalar yapan David Baker ile de paylaşıldı.
Proteinlerin üç boyutlu yapısını, amino asit dizilerinden yola çıkarak tahmin edebilmek, bilim insanlarının yıllardır çözmeye çalıştığı bir problemdi. Nobel komitesi, Hassabis, Jumper ve Baker’ın bu soruna çözüm getirerek bilim dünyasında devrim niteliğinde bir başarıya imza attıklarını belirtti.
2024’te hem fizik hem de kimya alanında verilen Nobel ödüllerinin yapay zeka ile bağlantılı olması, bilimin giderek disiplinler arası hale geldiğini gözler önüne seriyor. Fizikte ödül, makine öğreniminin temellerini atan bilgisayar bilimcilerine verilirken, kimya ödülü ise proteinlerin nasıl katlandığı gibi biyolojik bir bilmecenin çözümünde makine öğrenimini kullanan araştırmacılara gitti.
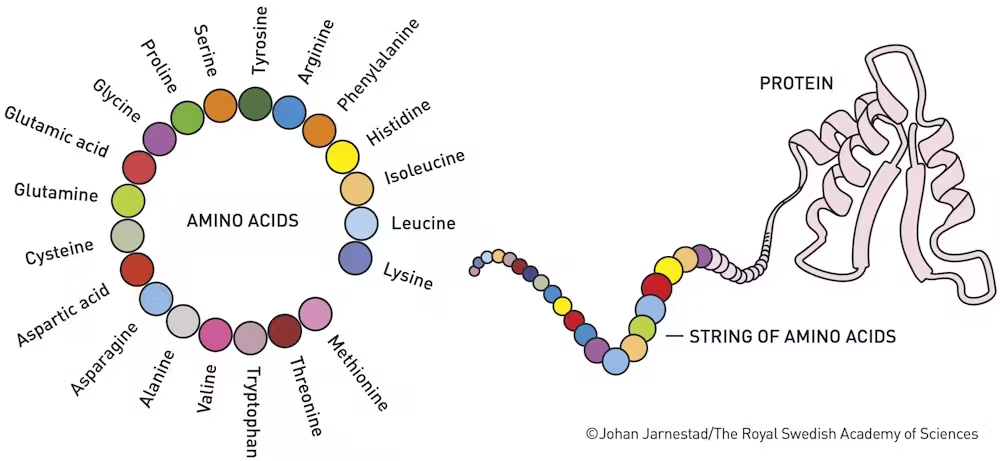
Protein Katlanma Problemi
Proteinler, yaşamın temel moleküler makineleri olarak işlev görür ve vücudumuzdaki kaslar, enzimler, hormonlar ve kan gibi birçok yapıyı oluşturur. 1972’de Christian Anfinsen, bir proteinin amino asit dizisinin, onun katlanmış üç boyutlu yapısını ve dolayısıyla fonksiyonunu belirlediğini keşfederek Nobel Kimya Ödülü’nü kazandı. Ancak, bir proteinin yanlış katlanması durumunda fonksiyon bozuklukları ortaya çıkabilir ve Alzheimer, kistik fibrozis veya diyabet gibi hastalıklara yol açabilir.
Protein katlanma sürecini anlamak, bilim insanları için uzun yıllar boyunca büyük bir zorluk teşkil etti. Bir proteinin doğru şekilde katlanmasını tahmin edebilmek için, onun amino asit dizisine bakarak bu karmaşık yapıyı çözmek gerekiyordu. Ancak bu süreç, binlerce atom arasındaki kimyasal etkileşimlere bağlı olduğundan oldukça karmaşık bir problem olarak kaldı.
David Baker, 2003 yılında geliştirdiği Rosetta programı ile proteinlerin yapısını tasarlamak için bir yöntem buldu. Ancak, bu süreçte seçilen yapı basitken, hesaplamalar son derece karmaşıktı. Bilim insanları, protein tasarımında rutin olarak ilerleme kaydedebilmek için yeni bir paradigmaya ihtiyaç duyuyordu.
Yapay Zeka Çağı ve Protein Tasarımı
Yapay zeka, büyük veri setlerini analiz ederek öğrenen bir teknoloji olarak birçok alanda kullanılıyor. Oyunlardan özerk araçlara ve bilimsel araştırmalara kadar geniş bir yelpazede uygulamalar buldu. 2010’da Demis Hassabis tarafından kurulan DeepMind, bu potansiyeli gerçeğe dönüştürmek için yapay zekayı nörobilimle birleştirmeyi hedefledi. Hassabis’in liderliğindeki ekip, 2017 yılında satranç ve Go oyunlarında insanüstü seviyede oynayabilen AlphaZero ve AlphaGo gibi sistemlerle büyük başarılar elde etti.
Ancak DeepMind ekibi, yalnızca oyunlarla sınırlı kalmadı. 2016’da protein katlanma problemine odaklanarak AlphaFold projesini başlattılar. John Jumper liderliğindeki ekip, AlphaFold’u geniş bir protein veri tabanında eğiterek proteinin amino asit dizisine dayalı olarak 3D yapısını tahmin etmesini sağladı. AlphaFold2, bu karmaşık biyolojik problemi çözmede çığır açan bir başarı elde etti ve bugüne kadar 200 milyonun üzerinde proteinin yapısını tahmin etti. Bu veri tabanı, biyoloji, tıp ve ilaç geliştirme alanlarındaki araştırmaları hızlandırıyor.
AlphaFold, ilk olarak 2018 yılında Protein Yapı Tahmininin Kritik Değerlendirilmesi (CASP) yarışmasında tanıtıldı. Daha sonra 2020’de tanıtılan AlphaFold2, bilim dünyasında büyük bir yankı uyandırdı. Bu yeni yapay zekâ modeli, proteinlerin yapısını büyük bir doğrulukla tahmin ederek biyoloji alanında devrim niteliğinde bir gelişmeye imza attı. DeepMind’in bu teknolojiyi bilim insanlarıyla paylaşması, protein yapılarının daha hızlı ve kolay bir şekilde tahmin edilmesine olanak sağladı.
AlphaFold, genetik veri tabanlarındaki milyonlarca protein dizisinden faydalanarak bu proteinlerin olası yapılarını tahmin ediyor. 2021 yılında, DeepMind AlphaFold’un temel kodunu ve verilerini bilimsel toplulukla paylaştı ve Avrupa Moleküler Biyoloji Laboratuvarı’nın Avrupa Biyoinformatik Enstitüsü ile birlikte, genetik veri tabanlarında yer alan organizmalardaki proteinlerin neredeyse tüm yapılarını içeren bir veritabanı oluşturdu. Bu veri tabanı, şu anda 214 milyon tahmin içeriyor.
Hastalıklarla Mücadelede Tasarım Proteinleri
Proteinlerin nasıl katlandığını ve işlevlerini anlamak, hastalıklarla mücadelede yeni ilaçların tasarlanması açısından büyük önem taşıyor. Proteinler, biyokimyasal reaksiyonları hızlandıran enzimler gibi işlevler üstleniyor. Bir proteinin yapısını tahmin edebilmek, bilim insanlarına ilaç moleküllerinin nereye bağlanabileceğini belirleme şansı tanıyor. Bu da yeni ilaçlar geliştirilmesinde ilk adımı oluşturuyor.
2024 yılında DeepMind, AlphaFold’un yeni bir versiyonunu piyasaya sürdü. AlphaFold3, sadece protein yapısını tahmin etmekle kalmayıp, aynı zamanda küçük moleküllerin bağlanma noktalarını da belirliyor. Bu da araştırmacılara daha kesin hedeflere yönelik ilaçlar tasarlama imkanı sunuyor. Google’ın DeepMind’ı satın alması ve sonrasında Isomorphic Labs adlı yeni bir girişim kurarak ilaç geliştirme alanında işbirliği yapması, bu teknolojinin ticarileşmesine de olanak sağlıyor.
David Baker ise Washington Üniversitesi’ndeki ekibiyle birlikte protein tasarımında önemli gelişmeler kaydetmeye devam ediyor. “Family-wide hallucination” adını verdikleri bir yöntemle sıfırdan yeni proteinler tasarladılar. Bu yöntemle elde edilen proteinler arasında ışık yayan bir enzim de bulunuyor. Bu yapay zeka araçları, doğada evrimleşmemiş tamamen yeni proteinlerin tasarlanmasına imkan tanıyor.
AlphaFold’un, bilimsel araştırmalarda ne kadar etkili olacağı henüz tam olarak bilinmese de, aracın şimdiden büyük keşifler yapılmasına yardımcı olduğu kesin. Bilim insanları, AlphaFold’un sunduğu protein yapısı tahminleriyle yeni keşiflere imza atmaya devam ediyor. Örneğin, bir araştırma grubu AlphaFold’un verilerini kullanarak hücrelerdeki nükleer por kompleksinin yapısını haritaladı. Başka ekipler ise bu veritabanını tarayarak yeni protein aileleri keşfettiler.

Geleceğin Bilimsel Çalışmaları İçin Yapay Zeka
2024 Nobel Kimya Ödülü sahiplerinin başarıları, yapay zekanın sadece bilgisayar bilimleri için değil, biyoloji ve tıbbın geleceği için de temel bir araç olduğunu gösteriyor. Protein katlanma probleminin çözülmesi, ilaç keşfi, kişiselleştirilmiş tıp ve yaşamın kimyasını anlama konusunda yeni ufuklar açıyor.
DeepMind, AlphaFold’un geliştirilmesine öncülük ederken, Washington Üniversitesi’nden David Baker da hesaplamalı biyofizik alanında önemli adımlar attı. Baker, AlphaFold’dan önce geliştirdiği Rosetta adlı yazılım ile protein yapılarını tahmin etmek için bir yol sundu ve bu yazılım proteinlerin yapısını modellemekte başarılı oldu. Daha sonra ise, bu yazılım tersine çevrilerek yeni proteinler tasarlamak için kullanıldı.
AlphaFold’un çıkışıyla birlikte, Baker’ın ekibi de RoseTTAFold adını verdikleri yeni bir sinir ağı geliştirerek AlphaFold’a benzer başarılar elde etti. Bu yapay zekâ araçları, protein tasarımını bilim insanları için daha erişilebilir hale getiriyor.
AlphaFold ve benzeri yapay zekâ destekli teknolojiler, bilim dünyasında büyük bir dönüşüm yaratıyor. Artık protein yapılarını tahmin etmek çok daha hızlı ve etkili bir şekilde yapılabiliyor. Bu teknolojiler, ilaç geliştirme süreçlerinden biyolojik keşiflere kadar geniş bir yelpazede önemli bir etki yaratmaya devam ediyor. Yapay zekâ, bilimsel araştırmaları hızlandırarak gelecekte daha büyük keşiflerin önünü açabilir.
Kaynak
https://www.nature.com/articles/d41586-024-03214-7
https://www.sciencealert.com/ingenious-ai-solution-to-protein-puzzle-wins-nobel-prize-in-chemistry




