Geleneksel olarak yaşam ve ölüm birbirine zıt kavramlar olarak ele alınır. Ancak, ölü bir organizmadan alınan hücrelerle yeni çok hücreli yapıların oluşması, yaşam ve ölüm sınırlarının ötesinde bir “üçüncü durum”u ortaya çıkarıyor. Bu durum, ölüm sonrası bazı hücrelerin işlevlerini nasıl sürdürebildiği sorusunu gündeme getiriyor.
Bilim insanları genellikle ölümü, bir organizmanın tüm işlevlerinin kalıcı olarak durması olarak tanımlar. Ancak organ bağışında olduğu gibi, bazı organ, doku ve hücreler organizma öldükten sonra işlevini sürdürebiliyor. Bu dayanıklılık, ölüm sonrası bazı hücrelerin işlevlerini nasıl koruyabildiğine dair mekanizmaların araştırılmasını sağlıyor.
Araştırmacılar bu çalışamda organizmalar öldükten sonra hücrelerde neler olduğunu inceledi. Yeni yayımlanan çalışmada, besin, oksijen, biyoelektrik veya biyokimyasal işaretlerle beslenen bazı hücrelerin ölüm sonrası çok hücreli yapılara dönüşme potansiyeline sahip olduğunu ortaya koydular.
Üçüncü Durum: Yaşam ve Ölüm Arasında Yeni Bir Boyut
Bu üçüncü durum, bilim insanlarının hücre davranışını anlamalarına farklı bir bakış açısı kazandırıyor. Tırtılın kelebeğe, kurbağa larvasının kurbağaya dönüşmesi gibi belirli bilindik gelişimsel dönüşümler olsa da, organizmaların önceden belirlenmemiş şekillerde değiştiği çok az örnek vardır. Tümör hücreleri, laboratuvar ortamında sürekli çoğalabilen HeLa hücreleri gibi hücre dizileri, yeni işlevler geliştirmedikleri için üçüncü duruma dahil edilmez.
Araştırmalarda, ölü kurbağa embriyolarından alınan deri hücrelerinin laboratuvar ortamında “xenobotlar ” olarak adlandırılan çok hücreli yapılara dönüştüğü gözlemlendi. Bu xenobotlar, orijinal biyolojik işlevlerinin ötesinde davranışlar sergileyerek çevrelerinde hareket edebiliyorlar. Örneğin, normalde kurbağa embriyolarında mukus hareketi için kullanılan kirpikçikler, bu yeni organizmalarda yön bulma ve hareket etme işlevi kazanmış durumda.
Xenobotlar ayrıca kendilerini fiziksel olarak kopyalayabiliyor, yani büyüme olmadan kendi yapısını ve işlevini tekrarlayabiliyor. Bu, canlı organizmaların vücut içinde büyüyerek üremesiyle farklılık gösteriyor.
Araştırmalarda, insan akciğer hücrelerinin de minyatür çok hücreli yapılara dönüşerek çevrelerinde hareket edebildikleri bulundu. “Antrobot” adı verilen bu yapılar, çevrelerinde dolaşmanın yanı sıra kendilerini ve çevrelerinde bulunan sinir hücrelerini onarabiliyor.
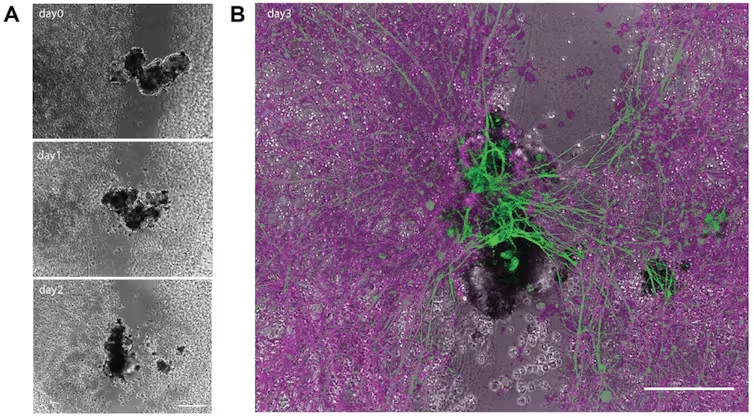
Ölüm Sonrası Koşullar ve Hücrelerin Dayanıklılığı
Bir organizma öldükten sonra bazı hücre ve dokuların yaşayıp işlevlerini sürdürüp sürdüremeyeceğini belirleyen birçok faktör var. Çevresel koşullar, metabolik faaliyetler ve koruma teknikleri bu süreci etkileyen ana faktörlerdir.
Farklı hücre türleri ölümden sonra farklı süreler boyunca hayatta kalabilir. Örneğin, insanlarda beyaz kan hücreleri ölümden sonra 60 ila 86 saat arasında hayatta kalırken, farelerde kas hücreleri ölümden 14 gün sonra dahi yeniden büyüyebilir. Dondurma gibi koruma teknikleri, kemik iliği gibi dokuların canlı vericilerden alınmış gibi işlev görmesini sağlar.
Araştırmacılar, ölüm sonrası bazı hücrelerin işlevlerini sürdürmesinin altında karmaşık elektriksel sinyallerin yattığına inanıyor. Hücre zarında bulunan kanallar ve pompalar, hücreler arasında iletişim sağlarken büyüme ve hareket gibi işlevleri gerçekleştiriyor. Ayrıca, ölüm sonrası bazı genlerin aktive olduğu ve bu genlerin stres, bağışıklık ve epigenetik düzenleme ile ilgili işlevler taşıdığı bulunmuştur.
Biyoloji ve Tıp İçin Yeni Perspektifler
Üçüncü durum, hücrelerin uyum yeteneklerini anlamanın yanı sıra, yeni tedavi olanakları için de fırsatlar sunuyor. Örneğin, bir bireyin kendi dokusundan elde edilen antrobotlar, bağışıklık tepkisi oluşturmadan ilaç taşıyabilir. Vücuda enjekte edilen mühendislik ürünü antrobotlar, ateroskleroz hastalarında damar plaklarını veya kistik fibroz hastalarında fazla mukusu temizleyebilir.
Bu çok hücreli organizmalar dört ila altı hafta içinde doğal olarak parçalanarak kendini yok etme özelliğine sahip, bu da potansiyel zararlı hücre büyümesini engelliyor. Organizmanın ölümünden sonra bazı hücrelerin nasıl işlev göstermeye devam ettiğini ve çok hücreli yapılara dönüşebildiğini anlamak, kişiye özel ve önleyici tıbbın gelişmesi açısından büyük bir potansiyel taşıyor.
Kaynak
https://theconversation.com/biobots-arise-from-the-cells-of-dead-organisms-pushing-the-boundaries-of-life-death-and-medicine-238176
https://onlinelibrary.wiley.com/doi/10.1002/advs.202303575



