Hücre içindeki genetik kararsızlık, yani DNA’nın yapısında meydana gelen bozulmaların düzgün şekilde onarılamaması veya bu bozulmaların zamanla birikmesi, kanserin en belirgin ve ayırt edici özelliklerinden biri olarak kabul ediliyor. Bu kararsızlık, hücrelerin normal işleyişini bozarak kontrolsüz bölünmelere ve genetik çeşitliliğin artmasına yol açabiliyor. Ancak uzun yıllardır bilim insanlarını meşgul eden temel sorulardan biri şuydu: Bu DNA hasarları hücreler bölündükçe nasıl aktarılıyor ve neden bazı hücreler daha fazla etkilenirken bazıları neredeyse hiç etkilenmiyor? Yakın zamanda yayımlanan kapsamlı bir çalışma, işte bu soruya ışık tutuyor. Gelin detaylarına birlikte bakalım.
Her Hücre Aynı Değil: Genetik ve Hücresel Farklılıkların Rolü
İster sağlıklı ister tümörlü bir dokuda olsun, hiçbir hücre birebir aynı değildir. Bu durum, hücresel heterojenlik olarak adlandırılır ve hem DNA’daki mutasyonlara hem de genetik olmayan değişimlere bağlı olarak ortaya çıkabilir. Hücreler bu farklılıklar sayesinde çevresel strese uyum sağlayabilir; ancak bu süreç, hastalık gelişimini tetikleyen özelliklerin kazanılmasına veya kanser hücrelerinin tedaviden kaçmasına da neden olabilir.
Gerçek Zamanlı Takip: DNA Hasarının Mirası
Geçmişte yapılan çalışmalar, onarılmamış DNA hasarlarının hücre bölünmeleri sırasında taşınarak yavru hücreler arasında farklılıklara yol açabileceğini göstermişti. Ancak bu araştırmalarda kullanılan DNA dizileme teknikleri, sürecin gerçek zamanlı olarak nasıl işlediğini gözlemlemekte yetersizdi. Öte yandan canlı hücre görüntüleme yöntemleri hücrelerin bölünmesini takip edebiliyordu, fakat tek tek DNA lezyonlarını izlemek mümkün değildi.
Bu sorunu aşmak için Panagopoulos ve ekibi, canlı hücrelerde DNA replikasyonu ve hasarını eş zamanlı olarak gözlemleyebilen çok modlu bir platform geliştirdi. CRISPR–Cas9 sistemiyle her hücreye floresan etiketler eklendi: yeşil etiket, PCNA proteini aracılığıyla DNA’nın ne zaman kopyalandığını; kırmızı etiket ise 53BP1 proteini sayesinde DNA hasarlarını gösterdi. Hücreler, üç gün boyunca her 30 dakikada bir mikroskop altında görüntülendi.
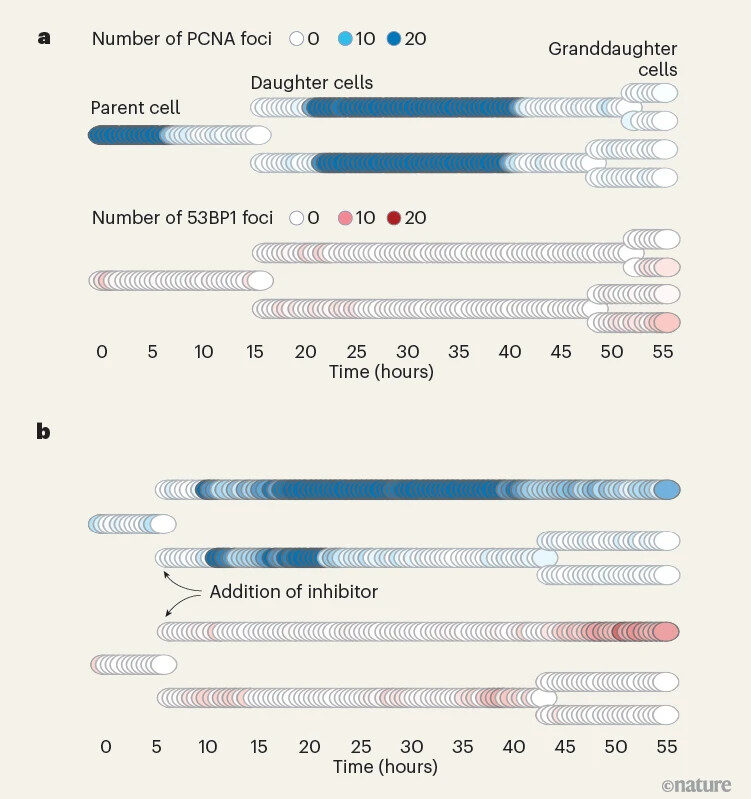
DNA Hasarı Hücre Soylarında Nasıl Farklı Yayılıyor?
Araştırmacılar, hücrelere DNA replikasyonunu zorlayan ilaçlar uygulayarak ya da doğrudan DNA’ya zarar veren radyasyon ve enzimler kullanarak testler yaptı. Sonuçlar dikkat çekiciydi: Yavru hücreler arasında DNA hasarı seviyeleri büyük farklılıklar gösterdi. Bu farklılıklar, hücre döngüsü düzenleyici proteinlerin değişken düzeylerde ifade edilmesine ve replikasyon zamanlamasında sapmalara yol açtı. Bu etkiler, bir sonraki (torun) hücre neslinde daha da belirgin hale geldi.
Ayrıca, ebeveyn hücrelerde tümör baskılayıcı proteinlerin azaltılması da benzer heterojenliğe yol açtı. Bu da, tümör baskılayıcı genlerin bozulmasının sadece doğrudan genetik bozukluklara değil, aynı zamanda hücresel çeşitliliğin artmasına da neden olabileceğini gösteriyor.
Genom Kararsızlığına Giden Yollar: Poliploidi ve Yeniden Replikasyon
Panagopoulos ve ekibi ayrıca poliploidi (bir hücrede genomun birden fazla kopyasının bulunması) gibi kanserle ilişkili durumları da inceledi. Poliploidi, ya hücre bölünmesinin gerçekleşmediği endoreplikasyon, ya da hücre döngüsü kontrolünün başarısız olduğu ve DNA’nın aynı döngüde tekrar kopyalandığı yeniden replikasyon yoluyla oluşabiliyor.
Araştırmacılar, bu iki süreci özel ilaçlarla tetikleyerek gözlemledi. Yeniden replikasyonun, endoreplikasyona kıyasla çok daha fazla DNA hasarı oluşturduğu görüldü. Bu bulgu, sadece poliploidinin varlığının değil, nasıl oluştuğunun da genom kararsızlığı üzerinde etkili olduğunu ortaya koydu.
Kanserin Evrimsel Yolculuğuna Işık Tutuyor
Çalışma, DNA hasarı ve onkogenik streslerin hücre soyları boyunca nasıl farklılıklar oluşturduğunu detaylı biçimde gösteriyor. Ayrıca bu yaklaşım, yalnızca genetik analizlere dayanmak yerine hücre döngüsü davranışlarını izleyerek yeni soruları gündeme getiriyor:
- Poliploid hücreler in vivo ortamda nasıl hayatta kalıyor?
- Genetik değişimlerin yanında epigenetik farklılıklar da izlenebilir mi?
- DNA’ya zarar vererek etki gösteren kanser tedavileri, istemeden hücresel heterojenliği artırıyor olabilir mi?
Kanserin Başlangıç Adımları Bir Hücre Bölünmesiyle Atılabilir
Panagopoulos ve ekibinin geliştirdiği sistem, geçici DNA hasarlarının hücre nesillerine nasıl kalıcı etkiler bırakabileceğini gözler önüne seriyor. Bulgular, bu tür heterojenliğin yalnızca kansere özgü olmadığını; sağlıklı hücrelerde de ortaya çıkabileceğini gösteriyor. Kısacası, bir hücre bölünmesiyle başlayan küçük bir hasar, uzun vadede kansere giden yolu şekillendirebilyor.
Kaynak
Reilly, E. L. & Aitken, S. J. Under the microscope: DNA damage tracked through cell generations. Nature (2025) doi:10.1038/d41586-025-01446-9.