Kanser immünoterapisi, özellikle Bağışıklık Kontrol Noktası İnhibitörleri (Immune Checkpoint Inhibitor, ICI) olarak bilinen ilaçlar, son on yılda kanser tedavisinde bir devrim yarattı. Vücudun kendi bağışıklık sistemini tümörlere saldırması için serbest bırakan bu tedaviler bazı hastalar için olumlu sonuçlar doğurdu. Ancak bu umut verici tabloya rağmen, önemli bir kısıtlama var: ICI’ler herkeste işe yaramıyor. Birçok hastanın bağışıklık sistemi, bu tedavilere yeterli yanıtı vermiyor. Yakın zamanda yapılan büyük bir araştırmadan elde edilen şaşırtıcı bir bulgu ise bu durumu değiştirebilir. Küresel bir salgınla savaşmak için kullandığımız yaygın bir araç olan COVID-19 mRNA aşısının, bu gelişmiş kanser tedavilerini daha etkili hale getirmenin anahtarını elinde tutuyor olabileceği ortaya çıktı.
Şaşırtıcı Gerçek: COVID Aşısı Olan Kanser Hastalarında Hayatta Kalma Oranları Önemli Ölçüde Arttı
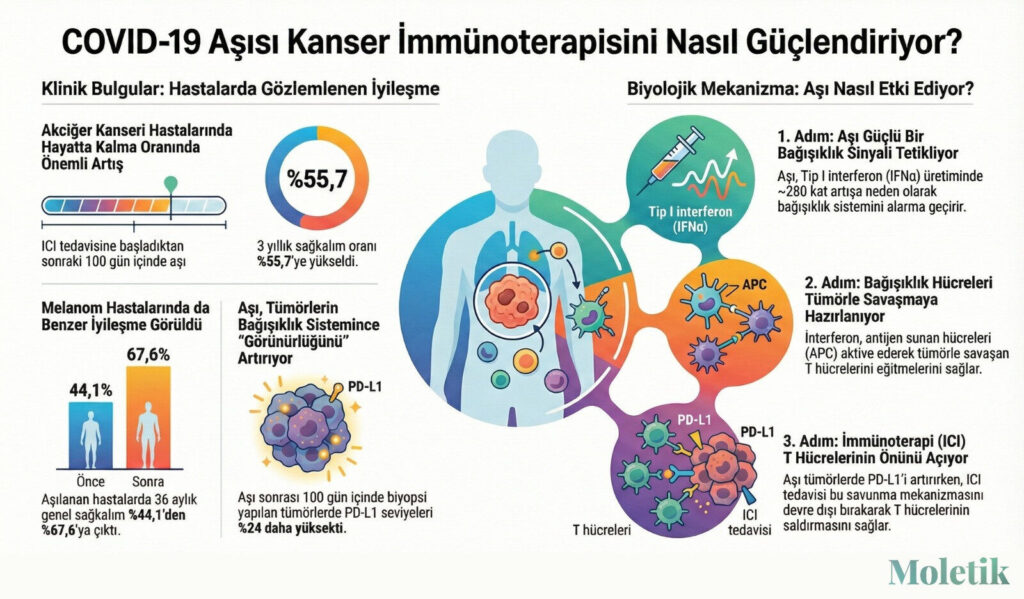
Geriye dönük bir çalışmanın temel bulgusu, kanser araştırmacıları için bile beklenmedik bir sonuç ortaya koydu. Immune Checkpoint İnhibitörü (ICI) tedavisine başlamadan önceki veya başladıktan sonraki 100 günlük kritik bir zaman dilimi içinde bir mRNA COVID-19 aşısı olan küçük hücreli dışı akciğer kanseri veya metastatik melanom hastaları, aşı olmayan hastalara kıyasla önemli ölçüde daha iyi hayatta kalma oranları gösterdi.
Veriler oldukça çarpıcı:
- Küçük Hücreli Dışı Akciğer Kanseri (KHDAK): Aşılanmamış hastalar için medyan genel sağkalım 20.6 ay iken, aşılanmış hastalarda bu süre 37.3 aya yükseldi. Bu, düzeltilmiş tehlike oranı (HRadj = 0.51) ile istatistiksel olarak da desteklenen güçlü bir bulgu.
- Evre IV Melanom: Aşılanmamış hastalar için medyan genel sağkalım 26.67 ay olarak ölçülürken, aşılanmış hastalar için medyan sağkalım süresine henüz ulaşılamadı, bu da analiz anında hastaların yarısından fazlasının hala hayatta olduğu ve hayatta kalma süresinin önemli ölçüde daha uzun olduğu anlamına gelmektedir. Bu gruptaki düzeltilmiş tehlike oranı ise daha da etkileyiciydi (HRadj = 0.37).
Bu bulguların güvenilirliğini artıran en önemli faktörlerden biri, araştırmacıların kanser evresi, hasta sağlık durumu ve tedavi yılı dahil olmak üzere 39 farklı değişkeni kontrol etmelerine rağmen sonuçların tutarlı kalmasıydı.
Aşılar Vücudun Bağışıklık Sistemini Kanserle Savaşmak İçin “Sıfırlıyor”
Aşının bu faydası, doğrudan kanseri hedef almasından kaynaklanmıyor. Asıl sır, mRNA teknolojisinin vücudun doğuştan gelen bağışıklık sistemini güçlü bir şekilde uyarma biçiminde yatıyor. Araştırmacılar bu etkiyi, bağışıklık ortamını “sıfırlayan” “viremi benzeri bir sitokin/kemokin yanıtı” olarak tanımlıyor.
Bu süreçte kritik bir rol oynayan molekül ise Tip I İnterferon (IFN). Her ne kadar diğer araştırmalar COVID aşıları için IL-1 sinyal yolunun önemine işaret etse de, bu çalışma belirleyici faktörün Tip I İnterferon olduğunu kanıtladı. Preklinik modellerde, IL-1 sinyalinin engellenmesinin tümör büyümesi üzerinde hiçbir etkisi olmazken, Tip I İnterferon sinyalinin engellenmesi aşının tümör karşıtı etkilerini “tamamen ortadan kaldırdı”.
Sağlıklı insan gönüllülerinden elde edilen bulgular ise bu mekanizmayı daha da aydınlatıyor: COVID-19 mRNA aşısı yapıldıktan sonraki 24 saat içinde, en çok artış gösteren sitokin olan IFNα’nın, başlangıç seviyesine göre ortalama 280 kat arttığı tespit edildi. Bu muazzam artış, fare modellerinde gözlemlenen ve aşının kanser karşıtı etkileri için temel teşkil eden interferon bağımlı mekanizmanın insanlarda da geçerli olduğuna dair güçlü bir kanıt sunuyor.
Bağışıklık Terapisine Yanıt Vermeyen Kanserleri Hedef Almak
Bazı kanserler, bağışıklık sistemi tarafından “görünmez” oldukları için immünolojik olarak “soğuk” kabul edilir. Bu tümörlerde önceden var olan bir bağışıklık aktivitesi yoktur ve genellikle düşük PD-L1 skoruna (örneğin, TPS <1%) sahiptirler. Bu durum, onların ICI tedavisine kötü yanıt vermesine neden olur.
Çalışma, mRNA aşılarının tümörlerde PD-L1 ekspresyonunu artırabildiğini ve böylece onları bağışıklık sistemi için daha “görünür” ve ICI tedavisine daha duyarlı hale getirdiğini ortaya koydu. Bu bulgu, fare modellerinde gözlemlenen ve aşıların tümörleri daha ‘görünür’ hale getirdiğini gösteren PD-L1 artışını doğrudan yansıtmaktadır, böylece klinik ve laboratuvar verileri arasında köprü kurmaktadır.
İşte kilit istatistik: Biyopsiden 100 günden daha kısa bir süre önce aşı olan küçük hücreli dışı akciğer kanseri hastalarının, PD-L1 TPS skorunun %50 veya daha yüksek olma olasılığı %29 daha fazlaydı. Bu, tedavi kararlarını değiştirebilecek klinik bir eşiktir.
Sonuç olarak, aşılanmış ve immünolojik olarak “soğuk” tümörlere (TPS <%1) sahip hastalar, tedaviye duyarlılıkları artarak, aşılanmamış ancak daha iyi bir başlangıç noktasına (TPS >%1) sahip hastalarınkine benzer genel sağkalım oranları sergiledi. Bu durum, aşının, immünoterapiye normalde zayıf yanıt veren bu hasta grubunda tedaviye duyarlılığı geri kazandırdığını düşündürmektedir.
Her Aşı Aynı Değil: Bu Etki mRNA Teknolojisine Özgü
Bu güçlü etkinin genel bir aşı etkisinden mi yoksa mRNA platformuna özgü bir özellikten mi kaynaklandığı önemli bir soruydu. Çalışma bu soruyu net bir şekilde yanıtlıyor. Araştırmacılar, ICI tedavisine başladıktan sonraki 100 gün içinde zatürre veya grip aşısı olan hastaları incelediklerinde, bu hastalarda hayatta kalma oranlarında hiçbir iyileşme olmadığını saptadılar.
Bu bulgu, gözlemlenen güçlü bağışıklık modülasyonu etkisinin, genel bir aşılamadan ziyade mRNA aşı platformunun benzersiz bir özelliği olduğunu vurgulamaktadır.
100 Günlük Kritik Pencere
Çalışmanın bir diğer önemli bulgusu ise zamanlamanın kritik rolüydü. Gözlemlenen pozitif ilişki, tutarlı bir şekilde belirli bir zaman dilimine bağlıydı: mRNA aşısının ICI tedavisine başlamadan önceki veya başladıktan sonraki 100 günlük kritik bir zaman dilimi içinde alınması. Bu sonuçlar bir araya getirildiğinde, tümörle ilişkili olmayan antijenleri hedef alan ve klinik olarak mevcut olan mRNA aşılarının, tümörleri ICI’lara duyarlı hale getirebilen güçlü bağışıklık modülatörleri olduğunu göstermektedir.
Kanser Tedavisinin Geleceği İçin Yeni Bir Ufuk
Bu çığır açıcı araştırma, immünoterapinin en inatçı zorluklarından birine beklenmedik bir çözüm sunuyor. Yaygın olarak kullanılan, “kullanıma hazır” bir bulaşıcı hastalık aşısının, immünolojik olarak uykuda olan “soğuk” tümörleri uyandırabildiği ve onları tedaviye duyarlı hale getirebildiği keşfedildi. Bu aşılar, bağışıklık sistemini kanserle daha etkili bir şekilde savaşması için yeniden programlayarak, daha fazla hastanın immünoterapiden faydalanmasını sağlayabilir.
Bu durum akla şu heyecan verici soruyu getiriyor: Bu bulgular, gelecekte kanser immünoterapisine yanıtı artırmak için özel olarak tasarlanmış evrensel mRNA “güçlendiricileri” geliştirmenin kapısını aralayabilir mi?
Not: Bu sonuçların kesin bir tedavi protokolü haline gelmesi için prospektif (ileriye dönük) klinik simülasyonların ve deneylerin gerçekleştirilmesi gerekmektedir. İçerikte bahsi geçen çalışma sonuçları tedavi önerisi olarak değerlendirilmemelidir.
Kaynak
Grippin, A. J. ve ark. SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade. Nature (2025). https://doi.org/10.1038/s41586-025-09655-y